DINÂMICA E PARTIÇÃO DE MARCADORES LIPÍDICOS NO ESTRATO CÓRNEO
QUEIRÓS, W.P; NETO, D. S; ALONSO, A
Instituto de física, Universidade Federal de Goiás, Goiânia 74001-970, GO, Brasil
e-mail, wellington.queiros@bol.com.br, Alonso@fis.ufg.br
Palavras chaves: Estrato Córneo, Ressonância Paramagnética Eletrônica, Marcadores Lipídicos.
INTRODUÇÃO
A
maior barreira para penetração de matéria
pela pele é fornecida pela camada superficial da pele, o estrato córneo
(EC). Entre outras propriedades, o EC controla a perda transpidermal de água e
a permeação de substâncias através da pele.
O EC é composto por células mortas, os corneócitos, formadas em seu interior por
proteínas chamadas queratinas, um envelope celular insolúvel de proteínas com
ligações cruzadas, e um envelope lipídico celular composto principalmente de ω-hidroxiceramidas
covalentemente ligados à periferia do envelope celular. Além disso, possui uma
complexa mistura lipídica na região intercelular os quais interligam com o envelope lipídico celular
formando uma estrutura conhecida como lamelas lipídicas.
A
composição dos lipídios é única. Ao contrário de outras membranas biológicas, o
EC é quase destituído de fosfolipídios e os principais constituintes são as
ceramidas 41%, colesterol 27%, ésteres de colesteril 10%, ácidos graxos livres
9%, e uma pequena fração de sulfato de colesterol 2%, o qual tem um importante
papel no processo de descamação do EC [1,2,3].
As
proteínas que compõem o interior do corneócitos são constituídas por cadeias
polipeptídicas ricas em ligações cruzadas de dissulfeto (S-S), as quais reduz a
absorção de drogas nas células. Por estas razões é que as substâncias ativas aplicadas sobre a pele
são difundidas ao longo das lamelas lipídicas na região intercelular [4]. Nos
últimos 20 anos, têm sido focalizados muitos estudos sobre a composição e
organização dos lipídios do estrato córneo e as mudanças envolvidas nestas
organizações como uma conseqüência de aplicação tópica de drogas, no tratamento
de doenças de pele, e para uma maior compreensão na função de barreira da pele.
MATERIAIS E MÉTODOS
·
AS membranas de EC são obtidas de ratos
recém-nascidos com menos de 24h.
·
O EC foi tratado com ácido oléico
aplicado diretamente sobre o EC marcado, em uma relação de (1:8, w/w) e
incubado em tampão (50 ml) por 1h.
·
A simulação dos espectros de RPE foi
feita com um programa desenvolvido por Freed e colaboradores, o “nonlinear
least –squares” (NLLS).
RESULTADOS E
DISCUSSÃO
Neste trabalho utilizamos a técnica de Ressonância Paramagnética eletrônica (RPE) de marcadores lipídicos derivados do ácido esteárico, com o grupo doxil (radical nitróxido) ligado nas posições 5, 12 ou 16 da cadeia metilênica (5-, 12- e 16-DSA), e também o estearato de metila marcado na posição 5 (5 DMSA), estruturados nos domínios lipídicos do EC, para investigar os efeitos de moléculas aumentadoras da permeação tais como o ácido oléico, sobre a dinâmica dos lipídios do EC. Após a análise dos espectros de (RPE) verificamos que ocorre à partição dos marcadores lipídicos com a formação de duas componentes espectrais caracterizadas por um equilíbrio termodinâmico; uma de menor mobilidade (componente 1) surge quando os marcadores de spin estão ligados na superfície polar das membranas e a de maior mobilidade (componente 2) é gerada pelos marcadores de spin inserido numa região mais hidrofóbico.
Através
da simulação foi possível estimar as populações relativas de spin de cada
componente do espectro, mostrando que a razão das populações das duas
componentes, N1/N2, na composição do espectro diminui com
o aumento da temperatura (Fig.1) e, uma vez que este processo é completamente
reversível, estas componentes estão claramente em equilíbrio termodinâmico.
Então estas duas componentes devem surgir dos dois estados intercambiáveis dos
marcadores de spin: (1) fazendo ligação de hidrogênio e (2) não fazendo ligação
de hidrogênio com as superfícies polares das camadas lipídicas.
Se
considerarmos que a relação das populações dos marcadores de spin é dada pela
distribuição de Boltzmann, e que estas estão em equilíbrio termodinâmico
podemos reescrever essa relação em termos dos potenciais termodinâmicos [5].
ln
N1/N2 = ln K = - ∆G0/RT = ∆S0/R
- ∆H0/RT, (1)
onde K é a constate de equilíbrio,
∆S0 e ∆H0 são as mudanças de entropia e
entalpia no estado de equilíbrio. A
equação (1) mostra que, na prática, os valores numéricos de ∆S0
e ∆H0 podem ser determinados a partir do gráfico de ln K X 1/T
(fig.1).

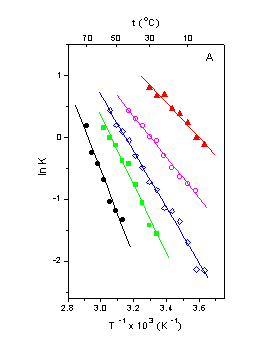
Como a maioria dos nitróxidos podem formar
ligação hidrogênio quando posicionados no 50 átomo de carbono da
cadeia hidrocarbonada o isômero 5 doxil
foi o mais fortemente ligado às superfícies polares (∆G02→1
= -1,75 Kcal/mol e ∆H02→1
=13,8 Kcal/mol) e como o 5 metil doxil mais lipofílico, a população de
spin estabilizada no meio hidrofóbico é maior (∆G02→1
= -0,57 Kcal/mol e ∆H02→1=
-9,1 Kcal/mol). No EC deslipidizado com a mistura de clorofórmio/metanol,
ocorre um aumento da interação do marcador com a superfície polar, decrescendo
a difusão rotacional. Ao contrário, o tratamento do EC com ácido oléico aumenta
drasticamente a mobilidade do marcador, particularmente aqueles da componente
1, e o equilíbrio termodinâmico é deslocado para a formação da componente 2.
CONCLUSÕES
·
Os resultados experimentais mostraram
que os ácidos graxos sofreram divisão dentro dos domínios lipídicos do EC com
uma classe de moléculas fazendo ligação de hidrogênio com a superfície polar e
a outra sem este contato e com mais mobilidade, é estabilizada mais
profundamente no meio hidrofóbico.
·
A posição do doxil no marcador de spin
afeta a energia livre e entalpia observada.
·
O marcador mais lipofílico 5-DMSA fica
mais inserido no core hidrofóbico.
·
No EC deslipidizado o marcador 16-DSA
aumentou sua estabilidade na região polar da membrana com uma redução no valor
de ∆G02→1
de +0,34 Kcal/mol para –0,51 Kcal/mol) implicando que a ausência de membranas intercelulares
diminui a probabilidades dos marcadores de spin formarem a componente 2 de
maior energia.
·
O
tratamento do EC com o ácido oléico, um aumentador de permeação da pele,
favorece a formação da componente 2, com um significante aumento na ∆G02→1
e uma redução na mudança de entalpia.
·
O
ácido oléico causa um aumento drástico na fluidez lipídica, especialmente na
região dos grupos polares.
REFERÊNCIAS
BIBLIOGRÁFICAS
[1]
SUHONEN, M. T; BOWSTRA, J. A; URTTI, A. (1999): Chemical enhancement of
percutaneous absorption in relation to stratum corneum alterations. Journal
controlled release. 149-161.
[2]
SHURER, N.Y; ELIAS, P.M. (1991): The biochemistry and function of stratum
corneum lipids. Progress in Lipid Research 24: 27-56.
[3]
BOWSTRA, J. A; NGUYEN, P. L. H; GOORIS, S. G; PONEC, M. (2003): Structure of
the skin barrier and its modulation by vesicular formulations. Progress in
Lipid Research 42: 1-36.
[4]
BOWSTRA, J. A; NGUYEN, P. L. H. (2002): Skin structure and mode of action
vesicles. Advanced Drug Delivery Reviews. 54: 41-55.
[5] COUTO, S.G. RPE de proteínas
marcadas nos resíduos de lisina: Efeitos da uréia em Estrato Córneo e Albumina.
(2003) Dissertação (Mestrado em Física)
Instituto de física, Universidade Federal de Goiás, Goiânia, 2003.
Fonte de financiamento:
Capes, CNPq