AVALIAÇÃO DA ATIVIDADE FOTOTÓXICA IN VITRO DE FURANOCUMARINAS EM CÉLULAS
DE MELANOMA HUMANO E FIBROBLASTOS HUMANOS NORMAIS
LEITE, V.C., 1 BRETAS,
M.L.2, SANTOS, R.F.3,
GUILLO, L.A.4
1,2,4Instituto
de Ciências Biológicas, 3Instituto de Química, Universidade Federal
de Goiás, Goiânia – GO ; andreuguillo@aol.com;
vanessacarneiroleite@hotmail.com
1. INTRODUÇÃO
As furanocumarinas mais comumente
conhecidas como psoralenos são agentes farmacológicos, isolados de plantas3.
Os psoralenos tem sido extensivamente estudados pelas suas propriedades
fototóxicas, tanto in vitro quanto in vivo. Essas propriedades envolvem a
interação com proteínas, lipídios de membrana e formação de mono ou biadutos
com o DNA. As lesões a nível de DNA são responsáveis pelo efeito
antiproliferativo e pela ação terapêutica dos psoralenos.4
Atualmente alguns derivados de psoralenos sintéticos tais como
4,5’,8-trimetilpsoraleno, 8-metoxipsoraleno e 7-metilpirido(3,4-c)psoraleno, em
combinação com radiação UVA (terapia PUVA), são empregados terapeuticamente no
tratamento de desordens proliferativas da pele como em psoríase e vitiligo. O
psoraleno 7-metilpirido(3,4-c)psoraleno, ainda não é empregado
terapeuticamente.3 A estrutura desses psoralenos está mostrada na figura 1. O exato mecanismo molecular
responsável pela eficácia da terapia PUVA, ainda é um assunto em debate.
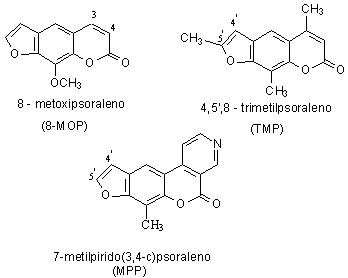
Figura 1: Fórmula estrutural das furanocumarinas estudadas
Modificações no DNA podem representar
um modo de ação terapêutica. Acredita-se que após a absorção de energia (luz
UVA), a molécula de psoraleno forma mono e biadutos, ocorrendo mais
freqüentemente com a base timina do DNA.2 O processo de formação de
mono e biaduto depende da estrutura do psoraleno, da seqüência de base do DNA e
da dose da radiação usada para a fotocicloadição. O arranjo geométrico das
furanocumarinas lineares durante a intercalação não-covalente, pode influenciar
enormemente a reação de fotocicloadição.5
Palavras-chave: furanocumarinas, fototoxicidade, in vitro, fotocicloadição
2. OBJETIVO
O presente trabalho teve como objetivo
geral avaliar o efeito antiproliferativo das furanocumarinas: 8-metoxipsoraleno,
4,5’,8-trimetilpsoraleno e 7-metilpirido(3,4-c)psoraleno em células de melanoma
humano comparativamente às células de
fibroblastos humanos normais em cultura.
3.
MATERIAIS E MÉTODOS
3.1 – Cultivo de células de melanoma humano e
fibroblastos humanos normais
As células da linhagem SKMEL 37 empregadas neste
estudo, foram mantidas em frascos de cultura de 75 cm2 e em meio MEM
(Sigma Chemica Co., St, Louis, USA) suplementados com 10% de soro fetal bovino
(Cutilab, Campinas, Brasil), penicilina e fungizona. As células de fibroblastos
humanos normais foram mantidas em condições de cultura semelhante à cultura de
melanoma, o meio usado para esse tipo de célula, foi o meio DMEM.
3.2 – Tratamento de melanoma humano e fibroblastos
humanos normais com cisplatina
Para o tratamento com cisplatina,
procedeu-se a adição de diferentes concentrações, as células foram incubadas
por 3 horas em salina HBSS com Ca2+, após esse período, retirou-se o
meio, acrescentando meio de cultura adequado. Após período de 24, 48 e 72 horas
foi realizado o ensaio MTT.
3.3 – Tratamento de melanoma humano e fibroblastos
humanos normais com psoralenos
As células de melanoma humano (linhagem SKMEL 37) e
fibroblastos humanos normais foram mantidas em cultura, incubadas com
diferentes concentrações de 8-MOP e TMP, irradiadas com luz UVA (0,3J/cm2)
e coletadas, para análise, em intervalos de 24, 48 e 72 horas. O efeito
antiproliferativo do psoraleno MPP somente foi observado em células de melanoma
humano. A fototoxicidade de 8-MOP, TMP e MPP, foi analisada pela medida da atividade
de desidrogenase mitocondrial (método do MTT).
3.4 – Metodologia utilizada na modelagem molecular de
psoralenos
A estrutura das furanocumarinas estudadas foi
construída e visualizada usando um modelo interativo construído pelo pacote
computacional TITAN, versão 1.0 da Wavefunction, Inc. Os cálculos foram
efetuados em uma Workstation Dell, modelo Precision 220.
4. RESULTADOS
E DISCUSSÃO
O fármaco cisplatina foi utilizado como
controle positivo e a concentração
inibitória (IC50) 24 horas após o tratamento foi de 21,06±0,004
µmol.L-1 em células de melanoma humano e 46,18±0,007 µmol.L-1
em células de fibroblastos humanos normais. A furanocumarina TMP apresentou
especificidade in vitro (IC50
= 0,28±0,005 µmol.L-1) por células de melanoma humano comparativamente
a fibroblastos humanos normais (IC50 >>500±0,046 µmol.L-1)
24 horas após o tratamento. Os valores de IC50 para células de
melanoma humano obtidos 72 horas após o tratamento com os derivados de
psoralenos foram: MPP = 0,045±0,005 µmol.L-1, TMP = 0,059±0,002
µmol.L-1, 8-MOP = 9,69±0,002 µmol.L-1, e para
fibroblastos normais foram: TMP = 0,097±0,005 µmol.L-1 e 8-MOP =
3,8±0,003 µmol.L-1. De acordo com os valores de IC50
obtidos a ordem de fototoxicidade observada foi MPP>TMP>8-MOP. Os
coeficientes de partição das furanocumarinas no sistema octanol/água foram
calculados no programa computacional TSAR e a ordem de lipofilicidade
encontrada foi: MPP>TMP>8-MOP. Esses dados estão de acordo com a ordem da
fototoxicidade observada. Através do programa computacional TITAN foi possível
constatar que a formação de monoadutos TMP e 8-MOP com a timina ocorre
preferenciavelmente no sítio 3,4 do anel pirano. O biaduto de TMP-timina, é
mais estável (∆Hf = -89,29 kcal/mol). O monoaduto MPP-timina
apresentou maior estabilidade (∆Hf = -58,226 kcal/mol) em
relação ao monoaduto formado por 8-MOP-timina (∆Hf = -16,78
kcal/mol), o que poderia estar relacionado com a alta fototoxicidade in vitro.
5.
CONCLUSÃO
Analisando os resultados obtidos no
presente trabalho, concluímos que as células de melanoma humano da linhagem
SKMEL 37 responderam ao tratamento in
vitro com cisplatina, validando o estudo com furanocumarinas. E que as
furanocumarinas estudadas apresentam efeito antiproliferativo in vitro sobre células de melanoma
humano e fibroblastos humanos normais, e esse efeito é dependente da estrutura
e da lipofilicidade dos derivados de psoralenos.
6. REFERÊNCIAS BIBLIOGRÁFICAS
1. COLOMBAIN, M.,
GOLL, V., MUYARD, F., GIRARD, C., BÉVALOT, F., RICHERT, L. A biossay using the
human hepatoblastoma cell line HepG2 for detecting phototoxicity of
furanocumarins. Plant Med, v. 67, p. 644-646, 2001.
2 - DIAWARA, M.M., TRUMBLE, J.T. Linear
furanocoumarins. In: FELIX D’MELLO, J.P.(ed). Handbook of plant and furgal
toxicants, 1997.
3- GOODMAN, A., e
GILMAN. As Bases Farmacológicas da
terapêutica. Traduzido por Lauro Sollero, 5 ed., Rio de Janeiro, Guanabara
Koogan, 1996.
4- LUFTL, M.,
ROCKEN, M., PELWIG, G., DEGITZ, K. PUVA inhibits DNA replication, but not gene
transcription at nonlethal dosages. The Society for investigative Dermatology,
Inc, v. 111, p. 399-405, 1998.
5 – MACHADO,
A.E.H., MIRANDA, J.A., OLIVEIRA-CAMPOS, A.M.F., SEVERINO, D., NICODEM, D.E.
Photophysical properties of two new psoralen analogs. Journal of Photochemistry
and Photobiology A: Chemistry, v. 146, p. 75-81, 2001.