
DESINTEGRAÇÃO, DISSOLUÇÃO E ESTABILIDADE DE COMPRIMIDOS REVESTIDOS CONTENDO ENALAPRIL EM FUNÇÃO DA ESPESSURA DO FILME DE REVESTIMENTO
Rodinelli Borges de Oliveira.1,2; Eliana Martins Lima1
1 - Laboratório de Tecnologia Farmacêutica – Faculdade de Farmácia – Universidade Federal de Goiás – Brasil - e-mail: emlima@farmacia.ufg.br
2- Mestrando em Química - UFG
RESUMO Enalapril é uma pró-droga, cujo produto de hidrólise no fígado é o enalaprilato, responsável por sua ação farmacológica. É utilizado no tratamento da hipertensão renina-dependente e, via oral, é bem absorvido pelo trato gastrintestinal. Nesse trabalho, comprimidos de enalapril 20 mg serão revestidos por filmes poliméricos para determinar sua influência sobre os principais fatores que influenciam nos processos de dissolução e revestimento, encontrando as melhores condições que determinam a espessura do filme de revestimento necessária para o perfil de desintegração e dissolução ideais. A avaliação da estabilidade também será realizada, com análise por HPLC e por UV.
Palavras chave: Enalapril, Dissolução e Revestimento
INTRODUÇÃO
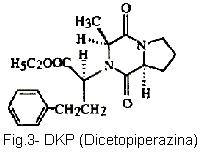
Enalapril é usado no tratamento da hipertensão renina-dependente. É uma pró-droga que só manifestará atividade biológica direta, quando, no fígado, for hidrolisada por estearases e transformada em enalaprilato, um inibidor competitivo da enzima conversora de angiotensina (ECA). A dose diária varia de 10 mg a 40 mg e é bem absorvido pelo trato gastrintestinal. A ação máxima do enalapril, na forma de inibição da ECA, ocorre 2 a 4 horas após a administração por via oral e seu efeito persiste por 24 horas ou mais. A conseqüência biológica dessa inibição é a redução dos níveis plasmáticos de angiotensina II e de aldosterona e um aumento da atividade da renina plasmática (NANAS et al., 2000). Em soluções aquosas ocorre hidrólise e ciclização desse fármaco. Em formulações farmacêtuicas sólidas, a estabilidade é essencialmente influenciada pela umidade e temperatura ambiente (STANISZ et al., 2003). Em testes de estabilidade de comprimidos expostos a uma alta temperatura e/ou alta umidade, observa-se que o enalapril forma dois produtos de degradação: enalaprilato (produto de degradação por hidrólise) e dicetopiperazina (DKP) (produto de degradação por ciclização) (Al-Omari et al., 2001; QIN et al., 1995). Conhecer seu comportamento in vivo e seu perfil de estabilidade é fundamental pois picos de concentração do fármaco no organismo podem provocar reações adversas como hipotensão. Para aumentar a estabilidade durante o período de armazenamento e proporcionar liberação contínua e concentração constante do fármaco no organismo, assim como tem sido feito com o captopril (NUR e ZHANG, 2000), os comprimidos de enalapril serão revestidos por um polímero biodegradável e biocompatível.
OBJETIVOS
Nesse trabalho, serão revestidos comprimidos de maleato de enalapril, 20 mg, com OPADRY® para verificar o seu perfil de desintegração e dissolução. O processo de revestimento será otimizado, identificando-se os principais fatores que influenciam na espessura do filme de revestimento, assim como o processo de dissolução, encontrando-se os fatores determinantes da quantidade e velocidade do fármaco dissolvido. O teste de estabilidade, tanto para os comprimidos revestidos como para os não revestidos, também será realizado para avaliar a eficácia do revestimento na proteção do núcleo do comprimido.
JUSTIFICATIVAS
A seleção do fármaco enalapril se deve principalmente à sua grande aplicação no controle da pressão arterial e à necessidade de se realizar maiores estudos em relação a sua biodisponibilidade e estabilidade. Além disso, a maioria das formas farmacêuticas disponíveis são comprimidos, sendo que alguns são revestidos e, a respeito destes últimos, existe uma grande carência de pesquisas direcionadas para a desintegração e dissolução em função do revestimento. A opção pelo OPADRY® é devido a sua praticidade e rapidez de preparação (45 min), não requer hidratação over night, reduz o contato da água com o produto, vida de prateleira estendida e elimina a manipulação de ingrediente da formulação do produto para o revestimento, o que poderia propiciar erros na sua constituição, alterando suas propriedades.
ESTRATÉGIAS METODOLÓGICAS
Inicialmente os comprimidos de enalapril 20 mg (excipientes: lactose, celulose microcristalina, talco, aminoglicolato de sódio, estearato de magnésio), serão revestidos com OPADRY® (Colorcon) utilizando-se o equipamento Mycrolab (modelo H00264 da Hüttlin). OPADRY® é um sistema completo de filme de revestimento que combina polímero, plastificante e pigmento em um concentrado seco. É preparado na proporção de 15% (w/w) em água ultrapura. Durante o processo de revestimento, serão retiradas amostras dos comprimidos a cada 10 min. Seis comprimidos de cada amostra coletada serão levados ao dissolutor (Vankel, modelo VK7000E) que está acoplado a um espectrofotômetro UV-Vis (Varian-Cary-50) e iniciado o processo de dissolução em água, 50 rpm (Aparato 2: USP 24-NF 19). A cada 5 min será coletada uma amostra de cada cuba para a leitura no espectrofotômetro (215 nm). A partir dessas leituras será construída uma curva da concentração do enalapril dissolvido em função do tempo. Esse procedimento funcionará inicialmente como uma triagem para se chegar as melhores condições de desintegração e dissolução em função do tempo de revestimento no Mycrolab. Para otimizar o processo de dissolução realizaremos um planejamento fatorial completo 32, ou seja, três níveis e dois fatores necessitando-se de um total de nove procedimentos. Os dois fatores que irão determinar a percentagem de fármaco dissolvido (resposta) serão o tempo do processo de dissolução e o tempo de revestimento no Mycrolab. Esse último corresponde a uma determinada espessura do filme de revestimento e após a otimização será determinada por microscopia eletrônica de varredura. Posteriormente, realizaremos um planejamento fatorial fracionário para otimizar as condições do Mycrolab. Isso permitirá avaliar quais fatores influenciam na espessura do filme de revestimento que será medido indiretamente pela quantidade do fármaco dissolvido (Dissolutor). Os fatores estudados serão: o fluxo de massa da solução de revestimento, a temperatura do ar de entrada, massa total dos comprimidos, o tempo do processo e a pressão do ar de entrada. Após essa triagem, poderemos saber quais são os fatores importantes e quais suas melhores condições para se ter a espessura do filme de revestimento determinada pelas necessidades da dissolução. Após essa fase de otimização que possibilitará se chegar a uma espessura do revestimento ideal, uma amostra dos comprimidos revestidos e uma de comprimidos não revestidos será mantida nas condições de 40oC de temperatura e 75% de umidade relativa, por seis meses. Após esse período, as amostras serão dissolvidas em tampão fosfato, pH 2,0, de maneira que se chegue a uma concentração de aproximadamente 40 mg de maleato de enalapril por 100 ml. Posteriormente, serão analisadas pelo método HPLC em que a fase móvel usada será uma mistura de tampão fosfato (pH 2)- acetonitrila (17:8, v/v). O tampão fosfato será preparado ajustando-se o pH do fosfato de potássio diidrogenado com ácido fosfórico para 2,0. O fluxo será de 1,5 ml/min. A detecção cromatográfica será ajustada a 215 nm usando um detector UV. O volume de injeção será de 50 m l.
FORMA DE ANÁLISE DOS RESULTADOS
Na determinação das condições ótimas para o Dissolutor e para o Mycrolab, os fatores realmente influenciadores nas respostas (quantidade do fármaco dissolvido e espessura do filme de revestimento) serão dispostos em gráficos onde se poderá identificar uma superfície de resposta na qual as melhores condições serão determinadas. A avaliação da estabilidade se restringirá à identificação e quantização dos produtos de degradação (enalaprilato-Fig. 2 e DKP-Fig. 3) do enalapril (Fig. 1). Espera-se que os comprimidos revestidos sejam menos atingidos pela degradação do princípio ativo.


FONTE DE FINANCIAMENTO
FINEP, FUNAPE, CAPES e CNPq
REFERÊNCIAS BIBLIOGRÁFICAS
AL-OMARI, M. M. et al. Effect of the drug-matrix on the stability of enalapril maleate in tablet formulations. Journal of Pharmaceutical and Biomedical Analysis, v. 25 (5-6), p. 893-902, 2001.
NANAS, John N. et al. Outcome of patients with congestive heart failure treated with standard versus high doses of enalapril: a multicenter study. Journal of the American College of Cardiology , v. 36 (7), p. 2090-2095, 2000.
NUR, Abubakr O.; ZHANG, Jun S. Recent progress in sustained/controlled oral delivery of captopril: an overview. International Journal of Pharmaceutics , v.194(2), p. 139-146, 2000.
QIN, Xue-Zhi; DE MARCO, Joe; IP, Dominic P. Simultaneous determination of enalapril, felodipine and their degradation products in the dosage formulation by reversed-phase high-performance liquid hromatography using a Spherisorb C8 column. Journal of Chromatography A, v. 707, p. 245-254, 1995.
STANISZ, Beata. Evaluation of stability of enalapril maleate in solid phase. Journal of Pharmaceutical and Biomedical Analysis, v. 31, p. 375-380, 2003.