EMPREGO DA TÉCNICA DE ESPALHAMENTO DE LUZ NA DETERMINAÇÃO DO DIÂMETRO MÉDIO DE LIPOSSOMAS OBTIDOS POR SONICAÇÃO
Carina P. I. Alves1,2, Danielle Guimarães A. Diniz1,3 , Eliana Martins Lima1
1-Univ. Federal Goiás / Fac. Farmácia–Lab. Tecnologia Farmacêutica–Goiânia-GO
2 – Mestranda em Ciências da Saúde;
3 – Doutoranda emCiências da Saúde
(carinaitapema@bol.com.br/emlima@farmacia.ufg.br)
Palavras-chave: Lipossomas, espalhamento de luz, tamanho.
Introdução: Lipossomas são estruturas esféricas, com dimensões variando entre alguns nanômetros a alguns micrômetros de diâmetro, em que uma fase aquosa é totalmente cercada por uma ou mais bicamadas de fosfolipídeos em forma de vesículas. Os sistemas lipossomais são constituídos basicamente por fosfolipídeos, esteróis e um antioxidante, resultando em sistemas uni e multilamelares formados espontaneamente quando os fosfolipídeos são dispersos em fase aquosa [Gregoriads,1995; Lasic,1989; Vemuri et al,1995]. Os sistemas lipossomais possuem a capacidade de encapsular substâncias hidrofílicas em seu cerne aquoso, lipofílicas e anfifílicas em suas bicamadas, atuando desta forma como potencias transportadores de fármacos. Neste sentido, a determinação e o controle do tamanho dos lipossomas é imprescindível, uma vez que a eficiência de encapsulação de um fármaco e o seu comportamento in vivo estão diretamente relacionados ao tamanho das vesículas [Matsuzaki et al,2000].
Materiais e Métodos: A preparação dos lipossomas foi realizada por sonicação a partir do método de hidratação de filme lipídico em tampão IPB utilizando fosfatidilcolina (PC), colesterol (CHOL), a
-tocoferol (T). Os equipamentos utilizados foram: ZetaSizer Nano (Malvern Instruments, UK), processador ultrassônico Misonix XL2020. Após cada minuto de sonicação, as amostras foram analisadas empregando a técnica de espalhamento de luz, obtendo-se o Z-average, que corresponde ao diâmetro aproximado dos lipossomas. A distribuição das populações lipossomais foi caracterizada utilizando o índice de polidispersibilidade, o qual é medido pela extensão da distribuição do tamanho das vesículas [Muller, M. et al,2004]. O processo de sonicação promove a fragmentação e a organização das bicamadas lipídicas e, à medida que a preparação é sonicada, as estruturas apresentam menor diâmetro até atingir um patamar constante.
Resultados e Discussão: Observou-se que adição de colesterol promove um aumento do diâmetro das vesículas, devido a melhores características de empacotamento da bicamada [Ghannam et al,1999; Cócera et al,2003]. Já a adição do a
-tocoferol não altera o perfil da preparação, devido ao seu baixo peso molecular, conferindo, entretanto, estabilidade química à preparação (Fig.1). A distribuição do tamanho dos lipossomas foi observada com o decorrer do tempo de sonicação, apresentando populações heterogêneas com predomínio de lipossomas de elevado diâmetro em tempo zero e populações homogêneas e de diâmetro reduzido após cerca de 10 minutos de sonicação (Fig.2,3,4).
|
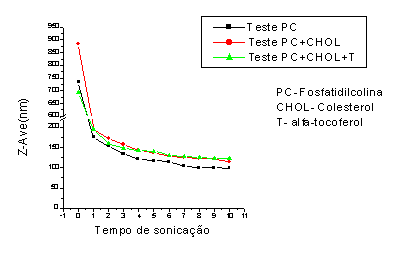
Figura 1: Perfil de formação de lipossomas.
|
|
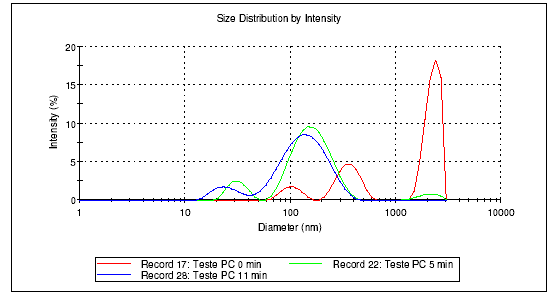
Figura.2- Lipossomas de fosfatidilcolina em tampão IPB-Análise ZetaSizer
|
|
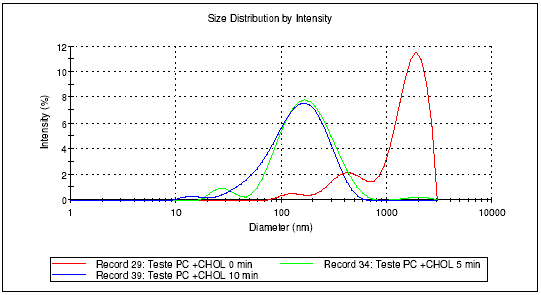
Figura 3: Lipossomas de fosfatidilcolina + colesterol em tampão IPB-Análise ZetaSizer
|
|
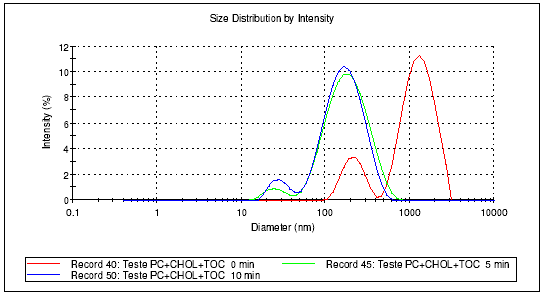
Figura 4: Lipossomas de fosfatidilcolina + colesterol + µ
-tocoferol em tampão IPB-Análise ZetaSizer
|
Conclusão: A Técnica de espalhamento de luz empregada permite realizar o acompanhamento do perfil de formação de lipossomas, a distribuição das populações lipossomais, a determinação do diâmetro das vesículas e as alterações decorrentes da adição de seus diferentes constituintes, caracterizando-se como uma técnica simples para a determinação do tamanho de lipossomas.
Referências:
CÓCERA, M.; LÓPES, O.; CODERCH, L.; PARRA, J.L.; MAZA, A. Permeability investigations of phospholipid liposomes by adding cholesterol. Colloids and Surfaces A: Physicochem. Eng. Aspects, v. 221, p. 9 -17, 2003.
GHANNAM, M. M.; MADY, M.M.; KHALIL, W. A. Interaction of tipo-I collagen with phospholipi monolayer. Biophys Chemis, v.80, p.31-40, 1999.
GREGORIADIS, G. Engineering lipossomes for drug delivery: progress and problems. Tibtech December, v.13, p.527-537,1995.
LASIC, D, D. Lipossome. Farm Vestn, v.40, p.197-208, 1989.
MATSUZAKI, K.; MURASE, O.; SUGISHITA K..; YONEYAMA S.; AKADA, K.; UEHA, M.; NAKAMURA, A .; KOBAYASHI, S. Optical characterization of liposomes by right angle light scattering and turbidity measurement . Biochimica et Biophysica Acta, v. 1467, p. 219-226,2000.
MÜLLER, M.; MACKEBEN, S.; MÜLLER–GOYMANN, C. C..Physicochemical characterisation of liposomes with encapsulated local anaesthetics. Int. J. Pharm, v. 274, p.139-148, 2004.
VEMURI, SRIRAM.; RHODES, C. T. Preparatation and characterization of lipossomes as therapeutic delivery systems: a review. Pharm Acta Helv, v. 70, p.95-111, 1995.
Fonte de Financiamento:
Finep, CNPq, Funape



