Otimização do sistema ternário de
solventes água-etanol-clorofórmio
para a determinação de íons Co
(II)
PAIXÃO E SILVA1, G.L. ; DE OLIVEIRA, A. E2; SOARES, M. H. F. B2
1- Escola de Agronomia e Engenharia de Alimentos- xpaixao@hotmail.com
2- Instituto de Química- elcana@quimica.ufg.br
Palavras- chave: análise de superfície de resposta, Cobalto (II), sistema ternário
Introdução
O cobalto participa como cofator de enzimas importantes ao
metabolismo do Nitrogênio, em plantas dependentes da fixação biológica do N2,
como o caso da soja. A quantidade de Co2+ exigido pelas plantas é
diminuta, a sua quantificação analítica exige métodos sensíveis e de baixo
limite de detecção, que é o caso da extração por sistema ternário de solventes,
(VIDOR, 1998).
Na extração por fase única, o Cobalto é extraído com PAN
(quelante), no processo de formação de uma fase líquida (FU) formada por água –
etanol – clorofórmio, pelo excesso do solvente aquoso ocorre a separação em uma
fase aquosa (FA) e uma fase orgânica (FO), rompendo-se o equilíbrio e extraindo
o complexo formado, que fica na fase orgânica, que é em seguida , quantificado
por espectrofotometria no visível (l=580 nm), (SILVA, 1992).
Condições ótimas de extração e/ou determinação de íons
Co(II) com PAN no sistema água-etanol-clorofórmio para fins de estudos em
alimentos podem ser obtidas empiricamente. Uma generalização da metodologia
obtida só poderá ser alcançada se conhecermos quimicamente o sistema; tendo-se
por finalidade a obtenção das condições
ótimas para a quantificação de Co(II) em folhas de soja nesse sistema ternário,
usando um planejamento centróide simplex, (BARROS NETO, 2001; SPENDLEY, 1962).
O mapeamento de três variáveis de concentração em função do pH e a metodologia de analise de superfície de resposta pode ser feito por modelo cúbico especial para a otimização e uma maior extração do íon Co(II), (STARY, 1964).
Material e Método
Preparou-se soluções aquosas para as concentrações de CoSO4 à 1,5 e 10 mg/L nos pHs 2-3, 6 e 8-9,5.
Em seguida fez-se sete experimentos, utilizando o planejamento centróide simplex (Tabela 1) nos pHs 2-3, 6 e 8-9,5 para as concentrações de CoSO4 à 1,5 e 10 mg/L.
|
Tabela 1-
planejamento centróide simplex para o sistema ternário: água, etanol e
clorofórmio |
|||
|
Ponto (i) |
Solução CoSO4
(x1) |
Etanol (x2) |
Clorofórmio-PAN
(x3) |
|
1 |
1 |
0 |
0 |
|
2 |
½ |
½ |
0 |
|
3 |
0 |
1 |
0 |
|
4 |
0 |
½ |
½ |
|
5 |
0 |
0 |
1 |
|
6 |
½ |
0 |
½ |
|
7 |
1/3 |
1/3 |
1/3 |
A partir das absorvâncias das misturas obtidas à 580nm , utilizou-se o modelo cúbico especial (equação 1) para a obtenção da superfície de resposta da extração de íons Co2+ em função das composições dos solventes.
![]() (Equação 1),
(Equação 1),
Onde ![]() representa as
absorvâncias encontradas;
representa as
absorvâncias encontradas; ![]() e
e ![]() são os parâmetros do modelo, e
são os parâmetros do modelo, e ![]() e
e![]() as composições dos componentes 1, 2 e 3 ( no caso:
solução de CoSO4 , etanol e clorofórmio-PAN, respectivamente), com a
restrição
as composições dos componentes 1, 2 e 3 ( no caso:
solução de CoSO4 , etanol e clorofórmio-PAN, respectivamente), com a
restrição ![]() .
.
Resultados e Discussão
A leitura das absorções referentes as misturas nos pHs 2-3, 6, 8-9,5 nas concentrações de CoSO4 de 1, 5 e 10 mg/L encontram- se Tabela 2.
|
Tabela 2- absorvâncias
médias das misturas do planejamento centróide simplex à 580nm nas
concentrações de CoSO4 à 1, 5 e 10mg/L |
||||||||
|
ponto |
pH
2-3 |
pH
6 |
PH 8-9.5 |
|||||
|
Abs1 |
Abs2 |
Abs3 |
Abs1 |
Abs2 |
Abs3 |
Abs1 |
Abs2 |
|
|
1 |
0,0000 |
0,0000 |
0,0000 |
0,0465 |
0,0020 |
0,00945 |
0,0000 |
0,0000 |
|
2 |
0,0015 |
0,0005 |
0,0020 |
0,0105 |
0,0035 |
0,0115 |
0,0005 |
0,0005 |
|
3 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
|
4 |
0,0575 |
0,0575 |
0,0575 |
0,0575 |
0,0575 |
0,0575 |
0,0575 |
0,0575 |
|
5 |
0,0505 |
0,0505 |
0,0505 |
0,0505 |
0,0505 |
0,0505 |
0,0505 |
0,0505 |
|
6 |
0,0255 |
0,0605 |
0,0290 |
0,1245 |
0,0996 |
0,1455 |
0,0285 |
0,0195 |
|
7 |
0,0510 |
0,0570 |
0,0470 |
0,2050 |
0,1250 |
0,2455 |
0,0485 |
0,1015 |
1- Quando utilizada solução
de CoSO4 na concentração de 5mg/L
2- Quando
utilizada solução de CoSO4 na concentração de 10mg/L
3-
Quando utilizada solução de CoSO4 na concentração de 1mg/L

 A partir desses resultados foram obtidas curvas para as
superfícies de resposta. As curvas em pH 6 nas concentrações de 1 e 5 mg//L de
CoSO4, constam nas figuras 1 e 2.
A partir desses resultados foram obtidas curvas para as
superfícies de resposta. As curvas em pH 6 nas concentrações de 1 e 5 mg//L de
CoSO4, constam nas figuras 1 e 2.
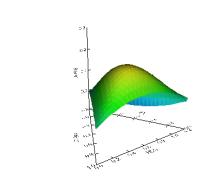
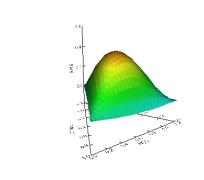


 Com base nas superfícies de resposta obtidas, verifica-se
que em pH ácido, ou básico, ocorre um deslocamento do pico de maior absorção.
Observa-se também que ocorre um decréscimo significativo dos valores de
absorvância referentes ao complexo Co(II)-PAN
quando se muda tanto a faixa de pH, quanto a quantidade do analito a ser
extraído. Desse modo, a condição ótima de análise ocorre quando os três
solventes apresentam a mesma proporção na mistura, ou seja 1:1:1, em pH neutro,
como pode ser verificado na Figura 1, acima.
Com base nas superfícies de resposta obtidas, verifica-se
que em pH ácido, ou básico, ocorre um deslocamento do pico de maior absorção.
Observa-se também que ocorre um decréscimo significativo dos valores de
absorvância referentes ao complexo Co(II)-PAN
quando se muda tanto a faixa de pH, quanto a quantidade do analito a ser
extraído. Desse modo, a condição ótima de análise ocorre quando os três
solventes apresentam a mesma proporção na mistura, ou seja 1:1:1, em pH neutro,
como pode ser verificado na Figura 1, acima.
A
condição ótima para a extração de Co(II) é diferente da encontrada na literatura.
Essa última caracteriza-se pela análise em uma região acima da curva binodal
(fase única), o que, de acordo com a superfície apresentada, não representava o
valor real do analito.
Conclusões
Por meio de um planejamento
estatístico do modelo cúbico especial, a condição ótima para a determinação de
íons Co(II) em sistema ternário (água-etanol-clorofórmio) ocorre quando os três
solventes apresentam a mesma proporção na mistura, ou seja, 1:1:1, em pH
neutro; diferentemente do proposto na literatura.
Referências
Bibliográficas
BARROS NETO, B.; SCARMINIO,
I. S., BRUNS, R. E.Como fazer
experimentos: pesquisa e desenvolvimento na ciência e na indústria, Editora
da Unicamp, 2001.
SILVA, J. F. da, MARTINS,
J. W.; Talanta, 39,1307, 1992.
SPENDLEY, W., HEXT, G. R. Chemometrics
4, p 441-461,1962.
STARY, J.; The Extraction of
Metals Chetales; Pergamon Press; Oxford, P 88,1964.
VIDOR, C.; PERES, J. R. R.; In Enxofre e Micronutrientes na Agricultura Brasileira; XVIII Reunião Brasileira de Fertilidade do Solo; Londrina, p. 38, 1998.
APOIO: FUNAPE, CNPq